तत्वों की आवर्त तालिका की रचना के डेढ़ सौ साल पूरे हो गए हैं और वर्ष 2019 को विभिन्न रसायन व भौतिकी संस्थाएं अंतर्राष्ट्रीय आवर्त तालिका वर्ष के रूप में मना रही हैं। आवर्त तालिका को रसायन शास्त्री अपनी सबसे महत्वपूर्ण उपलब्धि मानते हैं। इसने तत्वों को एक खास ढंग से वर्गीकृत करके हमें उनके गुणधर्मों और उनकी परमाणु रचना के बीच सम्बंधों को समझने में बहुत मदद की है। इस तालिका की मदद से रसायन शास्त्री और भौतिक शास्त्री विभिन्न तत्वों और उनके यौगिकों के बारे में पूर्वानुमान लगाने में समर्थ हुए हैं।
तत्वों के वर्गीकरण का एक लंबा इतिहास रहा है जिसकी परिणति मेंडेलीव द्वारा 1869 में निर्मित आवर्त तालिका के रूप में हुई थी। वैसे उसके बाद इस तालिका में कुछ छिट-पुट और कुछ बुनियादी परिवर्तन हुए हैं। मेंडेलीव का विचार था कि जब तत्वों को उनके परमाणु भार के क्रम में जमाया जाता है तो एक निश्चित अंतराल के बाद तत्वों के गुण दोहराए जाते हैं। इसे आवर्त नियम कहते हैं। आगे चलकर यह देखा गया कि परमाणु भार की बजाय यदि तत्वों की परमाणु संख्या (यानी किसी भी तत्व के नाभिक में उपस्थित प्रोटॉनों की संख्या) ली जाए तो यह नियम ज़्यादा सटीक बैठता है। वैज्ञानिकों की भाषा में यह नियम कहता है कि तत्वों के गुण उनकी परमाणु संख्या के आवर्ती फलन होते हैं। सरल शब्दों में कहें, तो यदि तत्वों को उनकी परमाणु संख्या के क्रम में जमाया जाए तो एक निश्चित अंतराल के बाद वही गुण दोहराए जाते हैं। आवर्त तालिका इसी नियम के आधार पर विकसित हुई है।
वैसे तत्वों के परमाणु भार और उनके गुणों के बीच सम्बंधों के पैटर्न को पहचानना तभी शुरू हो गया था जब डाल्टन ने परमाणु भार को परिभाषित करके उस समय ज्ञात तत्वों के परमाणु भारों की तालिका तैयार की थी। जैसे, 1816 में डॉबराइनर नामक रसायनज्ञ ने देखा कि समान गुणधर्मों वाले तत्वों की तिकड़ियां बनाई जा सकती हैं। इन तिकड़ियों की विशेषता यह थी कि यदि इन्हें परमाणु भार के क्रम में रखा जाए तो बीच वाले तत्व का परमाणु भार शेष दो तत्वों के परमाणु भार के औसत के बराबर होता है। उनके द्वारा बनाई कुछ तिकड़ियां निम्नानुसार थीं:
क्लोरीन, ब्राोमीन और आयोडीन
कैल्शियम, स्ट्रॉन्शियम और बैरियम
सल्फर, सेलेनियम और टेलुरियम
लीथियम, सोडियम और पोटेशियम
लेकिन तत्वों के वर्गीकरण का सबसे बड़ा और व्यवस्थित प्रयास एक भूगर्भ वैज्ञानिक डी चार्नकोर्टाइस ने 1862 में किया था। उन्होंने सारे तत्वों को उनके परमाणु भार के क्रम में एक बेलन पर सर्पिलाकार ढंग से जमाया जैसे चक्करदार सीढ़ियां होती हैं। ऐसा करने पर उन्होंने देखा कि एक समान गुणधर्मों वाले तत्व बेलन पर एक खड़ी लाइन पर सीध में आ गए। इसका मतलब था कि परमाणु भार के एक निश्चित अंतराल के बाद तत्वों के गुणधर्म दोहराए जाते हैं। लेकिन उनके इस विचार पर ज़्यादा ध्यान नहीं दिया गया।
लगभग इसी समय (1864 में) जॉन न्यूलैंड्स ने भी तत्वों के वर्गीकरण का प्रयास किया था। उन्होंने उस समय ज्ञात 62 तत्वों के 8 समूह बनाए और देखा कि इनमें कई जोड़ियां ऐसी हैं जिनके परमाणु भार में 8 का अंतर है और उनके गुणधर्म काफी मेल खाते हैं। इसके आधार पर उन्होंने एक नियम प्रतिपादित किया जिसे अष्टक का नियम कहते हैं।
इस तरह का एक और प्रयास मशहूर रसायनज्ञ लोथर मेयर ने भी किया था। उन्होंने भी पाया कि परमाणु भार के क्रम में जमाने पर तत्वों के गुण एक निश्चित अंतराल के बाद दोहराए जाते हैं। लोथर मेयर ने खास तौर से तत्वों के एक गुण पर ध्यान केंद्रित किया। उन्होंने क्ष-अक्ष पर परमाणु भार तथा य-अक्ष पर परमाणु आयतन लेकर ग्राफ बनाया तो देखा कि उसमें एक आवर्तता नज़र आती है – अर्थात परमाणु आयतन एक निश्चित अंतराल में घटता-बढ़ता है।
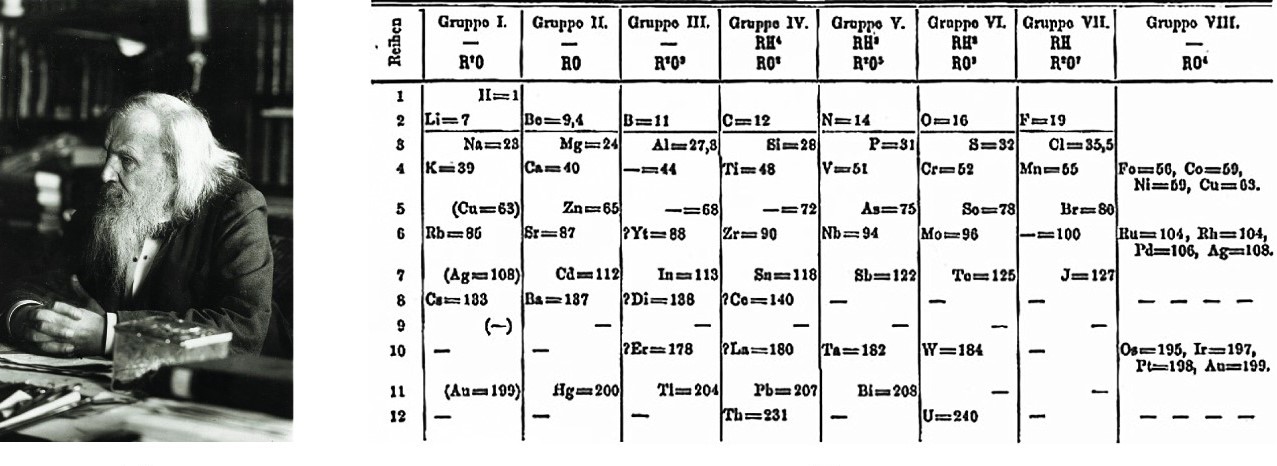
देखा जाए तो कई रसायनज्ञ तत्वों के गुणधर्मों को उनके परमाणु भार से जोड़कर देखने के प्रयास कर रहे थे। इन प्रयासों को मंज़िल तक पहुंचाने का काम दिमित्री मेंडेलीव ने किया। मेंडेलीव के प्रयास उक्त प्रयासों से एक महत्वपूर्ण मामले में भिन्न थे। मेंडेलीव ने यह माना कि उस समय तक सारे तत्वों की खोज नहीं हुई थी। अर्थात नए तत्व जुड़ने की पूरी संभावना थी। इसके बाद उन्होंने यह भी माना कि आवर्त नियम के अनुसार ही तत्वों को जमाया जाना चाहिए। यदि किसी स्थान पर आवर्त नियम नाकाम दिखता है तो मेंडेलीव ने माना कि वहां कोई नया तत्व फिट होगा। यानी उन्होंने मात्र उस समय ज्ञात तत्वों तक सीमित न रहते हुए उन तत्वों की भी कल्पना की जो आवर्त नियम के मुताबिक अस्तित्व में होने चाहिए।
अपने आवर्त नियम के आधार पर मेंडेलीव ने एक तालिका तैयार की जिसे आवर्त तालिका कहते हैं। अपने नियम के आधार पर कई मर्तबा वे बता पाए कि किसी तत्व का जो परमाणु भार निकाला गया है वह सही नहीं है क्योंकि उस परमाणु भार के आधार पर तत्व आवर्त तालिका में गलत स्थान पर आ रहा है। जैसे उन्होंने टेलुरियम के उस समय ज्ञात परमाणु भार पर संदेह व्यक्त किया था। और आगे चलकर इसके परमाणु भार में सुधार भी किया गया।
इसी प्रकार से यदि आवर्त नियम के अनुसार उनकी तालिका में कोई तत्व फिट नहीं हो रहा होता तो वे उस जगह को खाली छोड़ देते थे और भविष्यवाणी करते थे कि उस परमाणु भार वाला तत्व भविष्य में अवश्य खोजा जाएगा। वे तो उसके भौतिक व रासायनिक गुणधर्मों का भी एक मोटा-मोटा अनुमान प्रस्तुत करते थे। और उनके अनुमान सही पाए गए जैसी कि मेंडेलीव ने भविष्यवाणी की थी। जैसे वे अपनी आवर्त तालिका में खाली स्थानों को देखकर बता पाए थे कि एल्यूमिनियम, सिलिकॉन और बोरॉन जैसे गुणधर्मों वाले तत्व पाए जाएंगे। और वास्तव में ये तत्व जर्मेनियम, गैलियम तथा स्कैण्डियम के रूप में खोजे गए।
भविष्यवाणी की उपरोक्त ताकत का परिणाम था कि आवर्त नियम के आधार पर विकसित मेंडेलीव की तालिका रसायनज्ञों के बीच जल्दी ही स्वीकार कर ली गई। इसके बाद इस तालिका की कई समस्याएं पहचानी गर्इं और उनके समाधान के प्रयास आज भी जारी हैं। इनमें प्रमुख समस्याओं का सम्बंध तालिका में हाइड्रोजन के स्थान तथा लैंथेनाइड व एक्टिनाइड के स्थान से है। इस बारे में कई सुझाव आए हैं और विचार-विमर्श जारी है। (स्रोत फीचर्स)
नोट: स्रोत में छपे लेखों के विचार लेखकों के हैं। एकलव्य का इनसे सहमत होना आवश्यक नहीं है।
Photo Credit : https://s3-us-west-2.amazonaws.com/courses-images-archive-read-only/wp-content/uploads/sites/887/2015/04/23211054/CNX_Chem_02_05_Mendeleev1.jpg