डॉ. किशोर पंवार, डॉ. सुशील जोशी
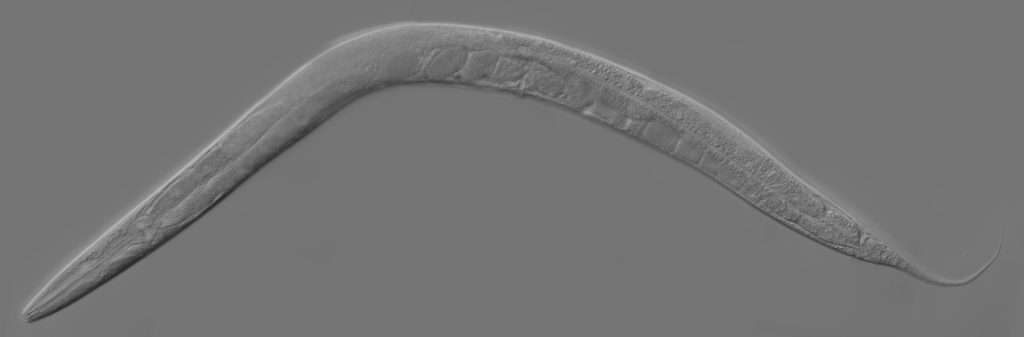
जब वैज्ञानिकों को नोबेल पुरस्कार (nobel prize) मिलता है, तो वे अमूमन अपने परिवार, सहकर्मियों, अपने विश्वविद्यालय या शोध का वित्तपोषण करने वालों का शुक्रिया अदा करते हैं। लेकिन जब विक्टर एम्ब्रोस (Victor Ambros) और गैरी रुवकुन (Gary Ruvkun) को वर्ष 2024 के कार्यिकी या चिकित्सा विज्ञान नोबेल सम्मान से नवाज़ा गया, तो रुवकुन ने चंद मिनट अपने प्रयोग के जंतु को दिए। वह जंतु है एक नन्हा-सा कृमि सीनोरेब्डाइटिस एलेगेन्स (Caenorhabditis elegans)। इस जंतु को उन्होंने ‘बडास’ की संज्ञा दी, अमरीकी बोलचाल में जिसका मोटे तौर पर मतलब होगा सख्तजान। यह मॉडल जीवों के इतिहास में एक मील का पत्थर था। वैसे इस जंतु पर शोध कार्य के फलस्वरूप 4 नोबेल पुरस्कार दिए जा चुके हैं। और रुवकुन ने ही नहीं, हर वैज्ञानिक ने अपने नोबेल व्याख्यान में इस नन्हे कृमि का शुक्रिया अदा किया है। जैसे 2002 में सिडनी ब्रेनर, जॉन सल्स्टन और रॉबर्ट होर्विट्ज़ को अंगों के विकास तथा पूर्व-निर्धारित कोशिका मृत्यु यानी एपोप्टोसिस सम्बंधी खोजों के लिए नोबेल पुरस्कार दिया गया था। अपने नोबेल व्याख्यान में सिडनी ब्रेनर ने कहा था, “इसमें कोई संदेह नहीं कि इस वर्ष के नोबेल पुरस्कार का चौथा विजेता सीनोरेब्डाइटिस एलेगेन्स है।”
वेब ऑफ साइन्स (Web of Science) डैटा के अनुसार 1980 से 2023 के बीच सी. एलेगेन्स से सम्बंधित 24,496 पर्चे प्रकाशित हुए। इनमें से यदि समीक्षा पर्चों को हटा दिया जाए, तो भी यह संख्या 20,322 होती है।
कैसा है यह कृमि
यह गोलकृमि (roundworm) मिट्टी में रहने वाला एक सरल जंतु है जो सड़े-गले कार्बनिक पदार्थ युक्त ज़मीन में पाया जाता है। ऐसी मिट्टी में पाए जाने वाले बैक्टीरिया ही इसका भोजन हैं। यह एक पारदर्शी जीव (transparent organism) है और यही इसकी एक खासियत है जो इसे एक मॉडल जीव बनाती है। 1900 में एमील मौपस ने इस प्रजाति को खोजा था और नाम रखा था रैबडायटिस एलेगेन्स। 1955 में एल्सवर्थ डोगर्टी ने इसे जीनस अर्थात वंश का दर्जा दिया और यह सीनोरेब्डाइटिस एलेगेन्स (सी. एलेगेन्स) हो गया।
मात्र 1 मिलीमीटर लंबाई वाले इस कृमि के दो लैंगिक रूप होते हैं – उभयलिंगी और नर। उभयलिंगी के शरीर में कुल जमा 959 कायिक कोशिकाएं होती हैं जबकि नर में 1031 होती हैं। तुलना के लिए देखें कि मनुष्यों में अरबों कोशिकाएं होती हैं। इसका जीवन चक्र (life cycle) मात्र तीन दिन का है – यानी 3 दिन बाद एक नया कृमि पैदा हो जाता है। इसके शरीर में न तो हृदय होता है, न रक्त परिसंचरण तंत्र, और न ही श्वसन तंत्र। शरीर कुल मिलाकर एक मुंह, ग्रसनी (pharynx), और जननांगों से मिलकर बना होता है। ऊपर से पारदर्शी क्यूटिकल का आवरण होता है। इसे प्रयोगशाला में पनपाना-पालना आसान है। यही सरलता इसे जीव विज्ञान का एक बहुमूल्य मॉडल बनाती है।
हालांकि कृमि और मनुष्य कई प्रकार से अलग हैं, फिर भी दोनों प्रजातियों के जीन्स और आणविक मार्गों में काफी समानताएं हैं। यदि आप यह पता लगा लें कि कोई कोशिकीय क्रियाविधि कृमि के विकास के दौरान कैसे काम करती है तो 95 प्रतिशत मामलों में यह इंसानों में भी बिल्कुल उसी तरह काम करेगी। इसका मतलब है कि कृमि पर किए गए वैज्ञानिक अध्ययन से प्राप्त जानकारी, मनुष्यों में बीमारियों और विकास के बारे में समझने में महत्वपूर्ण भूमिका निभा सकती है।
चूंकि यह कृमि पारदर्शी है, इसलिए इसमें नाभिकीय प्रवास (nuclear migration) सूक्ष्मदर्शी से जीवित जीव में ही देखा जा सकता है। भ्रूणावस्था में इसकी कोशिकाओं के तेज़ विकास तथा एक-एक कोशिका के अलग-अलग आसान अवलोकन की बदौलत प्रत्येक कोशिका की नियति का मार्ग देखा जा सकता है – इसे कोशिका नियति मानचित्र (cell fate map) कहा जाता है।
सी. एलेगेन्स का सर्वप्रथम अध्ययन तो विक्टर नाइगॉन और एल्सवर्थ डोगर्टी की प्रयोगशाला में 1940 के दशक में किया गया था लेकिन इसे एक मॉडल जंतु का दर्जा दिलवाने का काम 1963 में सिडनी ब्रेनर ने किया था जब उन्होंने इसे परिवर्धन के जीव विज्ञान और जेनेटिक्स के अध्ययन हेतु एक मॉडल के रूप में प्रस्तावित किया। 1974 में ब्रेनर ने जेनेटिक छंटनी के प्रारंभिक परिणाम प्रकाशित किए थे। उन्होंने शरीर रचना व कामकाज की दृष्टि से अलग-अलग सैकड़ों उत्परिवर्तित जंतुओं को पृथक किया था। 1980 के दशक में जॉन सल्स्टन तथा उनके सहकर्मियों ने वयस्क उभयलिंगी की समस्त 959 कायिक कोशिकाओं की कोशिका वंशावली का पूर्ण मानचित्रण किया। इसका अर्थ यह है कि इनमें से प्रत्येक कोशिका का, निषेचित अंडे से लेकर वयस्क तक का, संपूर्ण विकासात्मक इतिहास पता लगाया गया। इसी के साथ पहले-पहले जीन्स का क्लोनिंग किया गया और अंतत: 1998 में यह पहला बहुकोशिकीय जीव बना जिसके पूरे जीनोम का अनुक्रमण (genome sequencing) कर लिया गया था।
प्रारंभिक अनुसंधान
सी. एलेगेन्स का प्रथम विवरण 1900 में एमील मौपस द्वारा दिया गया था। उन्होंने इसे अल्जीरिया में मिट्टी में से हासिल किया था। बहरहाल, शुरुआती शोध कार्य तो इस बात पर केंद्रित रहा था कि इस कृमि का शुद्ध कल्चर (pure culture) तैयार कर लिया जाए, यानी जिसमें किसी अन्य प्रजाति की मिलावट न हो।
ट्रांसजेनेसिस (जीन हस्तांतरण)
ट्रांसजेनेसिस (transgenesis) किसी जीव के जीनोम में पराई आनुवंशिक सामग्री (एक ट्रांसजीन) को शामिल करने की प्रक्रिया है। इस प्रक्रिया के परिणामस्वरूप एक ट्रांसजेनिक जीव (transgenic organism) उत्पन्न होता है जो नए जीन को अभिव्यक्त करता है तथा एक संशोधित गुण या विशेषता प्रदर्शित करता है। यह किसी जीन की भूमिका को समझने का एक अच्छा तरीका हो सकता है।
सी. एलेगेन्स इस प्रक्रिया के लिए सर्वथा अनुकूल है। ट्रांसजेनिक कृमि तैयार करने का सबसे आम तरीका तो यह है कि बाहरी डीएनए को कृमि की एक सिंसिशियल जर्म लाइन में डाला जाए। सिंसिशियल जर्म लाइन वह होती है जिसमें जर्म कोशिकाएं (कोशिकाएं जो युग्मकों में विकसित हो सकती हैं) एक ही कोशिका द्रव्य साझा करती हैं, जिससे एक बहुकेंद्रकीय कोशिका बनती है। यह व्यवस्था विशेष रूप से युग्मक निर्माण की प्रक्रिया के दौरान देखी जाती है। दूसरा तरीका बायोलिस्टिक ट्रांसफॉर्मेशन (biolistic transformation) यानी मनचाहे डीएनए को सीधे लक्षित कोशिका में पहुंचाने का है।
सी. एलेगेन्स में इस प्रक्रिया का उपयोग करके कई महत्वपूर्ण समझ हासिल हुई हैं।
कोशिका व जंतु की मृत्यु
कोशिकाओं की मृत्यु बहुकोशिकीय जंतु विकास का एक अहम व सामान्य हिस्सा है। ऊतकों को तराशना, अंगों की संरचना का निर्माण, अंगों की साइज़ का नियंत्रण वगैरह स्वाभाविक कोशिका मृत्यु (एपोप्टोसिस – apoptosis) से तय होते हैं। जब स्वाभाविक कोशिका मृत्यु की प्रक्रिया गड़बड़ हो जाए, तो कई चीज़ें गड़बड़ा जाती है। मनुष्यों में कई बीमारियों में कोशिका मृत्यु सम्बंधी गड़बड़ियां शामिल होती हैं। इस दृष्टि से कोशिका मृत्यु (पूर्व निर्धारित या असमय) को समझना अनुसंधान का एक महत्वपूर्ण विषय है।
सी. एलेगेन्स उन कोशिकीय व आणविक प्रक्रियाओं (molecular mechanisms) का खुलासा करने में प्रमुख रहा है जो क्रमादेशित कोशिका मृत्यु (एपोप्टोसिस) का नियंत्रण करती हैं। हालांकि यह परिकल्पना तो बहुत पहले प्रस्तुत हो चुकी थी कि एपोप्टोसिस एक सुनियंत्रित प्रक्रिया है लेकिन कोशिका मृत्यु को नियंत्रित करने वाले कारकों का अध्ययन सर्वप्रथम सी. एलेगेन्स में ही किया गया था (2003)।
सबसे महत्वपूर्ण अवलोकन यह था कि एक ही उम्र के कृमियों में कोशिकाओं की संख्या और स्थान लगभग एक जैसे रहते हैं। अर्थात इस जंतु में कोशिकाओं के वंश लगभग अपरिवर्तित रहते हैं। इस प्रस्ताव में महत्वपूर्ण भूमिका इस बात की थी कि सी. एलेगेन्स की त्वचा का आवरण (क्यूटिकल) पारदर्शी होने की वजह से इसमें कोशिका विभाजन की प्रक्रिया का अध्ययन आसान है। इन प्रयासों की मदद से यह स्पष्ट हुआ कि सी. एलेगेन्स का उभयलिंगी व नर वयस्क तैयार होने के लिए सटीकता से 1090 और 1178 कायिक कोशिकाएं बन जाना ज़रूरी है। सी. एलेगेन्स के व्यवस्थित अध्ययन से एपोप्टोसिस, मृत कोशिका के मलबे को हटाने वगैरह की जटिल क्रियाविधि स्पष्ट हो पाई है। लेकिन हमने ऊपर देखा था कि वयस्क उभयलिंगी में मात्र 959 कोशिकाएं होती हैं। यहीं से एपोप्टोसिस का भान हुआ – एपोप्टोसिस के कारण 131 कोशिकाएं मृत हो जाती हैं, तो बची रहती हैं 959 (1090-131)। यह भी पता चला कि नर में एपोप्टोसिस में 147 कोशिकाएं मारी जाती हैं (1178-147=1031)। इस प्रक्रिया के विभिन्न लक्षण सी. एलेगेन्स में पहचाने गए और इनमें से कई लक्षण स्तनधारी कोशिकाओं में बने रहे हैं।
लेकिन कोशिका मृत्यु से अलग तंत्रगत ध्वंस वह प्रक्रिया है जो जंतु की मृत्यु का कारण बनती है। इस तरह की मृत्यु के कारक भी पहचाने गए हैं और यह भी देखा जा चुका है कि इन कारकों को बाधित करने से क्षय-जन्य मृत्यु को टाला जा सकता है।
प्रत्येक कोशिका के सटीक विकास मार्ग (कोशिका वंशावली) की जानकारी में से जो सबसे महत्वपूर्ण समझ हासिल हुई, उसका सम्बंध एपोप्टोसिस से है। कोशिकाओं की मृत्यु का अवलोकन तो कई जीवों में किया जा चुका था लेकिन सी. एलेगेन्स की कोशिका वंशावली ने दर्शाया कि एपोप्टोसिस विशिष्ट कोशिकाओं में, विशिष्ट समय पर होता है और यह एक विशिष्ट जैव-रासायनिक प्रक्रिया से संपन्न होता है जो सख्त जेनेटिक नियंत्रण में होती है। और तो और, यह भी स्पष्ट हुआ कि एपोप्टोसिस के लिए ज़िम्मेदार जीन्स जैव-विकास के दौरान जंतुओं में संरक्षित रहे हैं। और एपोप्टोसिस क्रियापथ में गड़बड़ी इंसानों में कई रोगों का कारण बनती है – जैसे, कैंसर, आत्म-प्रतिरक्षा रोग (autoimmune disease) और तंत्रिका-विघटन से सम्बंधित रोग। एपोप्टोसिस क्रिया पथ को कई बार कीमोथेरपी या रेडिएशन के द्वारा सक्रिय किया जाता है। कोशिका वंशावली और एपोप्टोसिस और सी. एलेगेन्स को जेनेटिक विश्लेषण के लिए एक मॉडल जीव के रूप में विकसित करने के शोध कार्य के लिए सिडनी ब्रेनर, जॉन सल्स्टन और एच. रॉबर्ट होविट्ज़ को 2002 में नोबेल पुरस्कार से सम्मानित किया गया था।
कोशिकाओं में संकेत लेन–देन
सिग्नल ट्रांसडक्शन (signal transduction) वह प्रक्रिया है जिसके ज़रिए कोई भी कोशिका बाह्य संकेत प्राप्त करती है, उसे प्रोसेस करती है और उस पर प्रतिक्रिया देती है। जंतुओं में लगभग सारे सिग्नल ट्रांसडक्शन मार्गों की खोज सी. एलेगेन्स (भ्रूण या उससे आगे की अवस्थाओं) के विभिन्न उत्परिवर्तियों पर अध्ययन के ज़रिए हुई है। मनुष्यों में अधिकांश कैंसर (cancer biology) में पाया गया है कि किसी न किसी सिग्नल ट्रांसडक्शन क्रियापथ में गड़बड़ी होती है। लिहाज़ा, इनकी समझ ने कैंसर जीव विज्ञान में भी काफी योगदान दिया है। हाल में, सी. एलेगेन्स में तंत्रिका संकेतों तथा इंसुलिन संकेतन के मार्गों का भी खुलासा हुआ है, जिसके चलते यह इस तरह के अध्ययनों के लिए आकर्षक मॉडल बन गया है।
बुढ़ाना
अंडा देने के बाद प्रयोगशाला की परिस्थितियों में कृमि का जीवनकाल (lifespan) करीब 14 से 21 दिन का होता है। ऐसे उत्परिवर्तित जंतु खोजे गए हैं जिनका जीवनकाल 50 से 100 प्रतिशत अधिक होता है। साथ ही कृमियों में जीवनकाल को बढ़ाने के लिए ज़िम्मेदार कई जीन्स भी पहचाने गए हैं। इनमें से अधिकांश जीन्स विभिन्न जंतुओं में संरक्षित रहे हैं और कुछ जंतुओं के बढ़े हुए जीवनकाल से सम्बंधित भी हैं। मनुष्यों में बुढ़ाना (aging process) एक जटिल प्रक्रिया है जिसमें लगभग सारे अंग-तंत्र प्रभावित होते हैं। इसलिए शुरू-शुरू में यह एक आश्चर्यजनक खोज थी कि विविध जंतुओं में बुढ़ाने की जैविक प्रक्रिया काफी एक समान है जबकि उनके जीवन काल में काफी अंतर होते हैं।
सी. एलेगेन्स बुढ़ाने की प्रक्रिया को समझने में एक महत्वपूर्ण मॉडल जीव रहा है। उदाहरण के लिए, देखा गया है कि इंसुलिन-नुमा वृद्धि कारक (आईजीएफ- IGF signaling) को बाधित कर दिया जाए तो वयस्क का जीवन तीन गुना तक बढ़ जाता है। दूसरी ओर, यदि ग्लूकोज़ खिलाया जाए तो उम्र आधी रह जाती है (जो ऑक्सीकारक तनाव की वजह से होता है)। इसी प्रकार से, यदि अधेड़ावस्था (कृमि की अधेड़ावस्था) में इंसुलिन/आईजीएफ का विघटन करवा दिया जाए तो जीवन में काफी वृद्धि हो जाती है। यह भी देखा गया है कि कृमि के लंबी उम्र वाले उत्परिवर्तित संस्करण ऑक्सीकारक तनाव (oxidative stress) और पराबैंगनी प्रकाश का प्रतिरोध दर्शाते हैं। ऐसे उत्परिवर्तियों में डीएनए की मरम्मत करने की क्षमता भी ज़्यादा थी। अर्थात डीएनए मरम्मत की क्षमता का सम्बंध लंबी उम्र से है जो उम्र के साथ कम होती जाती है।
एक मान्यता यह रही है कि डीएनए की ऑक्सीकारक क्षति बुढ़ाने की वजह होती है। सी. एलेगेन्स के अध्ययन से पता चला है कि सुपरऑक्साइड डिसम्यूटेज़ दिया जाए तो वह क्रियाशील ऑक्सीजन मूलकों को कम करता है और बुढ़ाने की प्रक्रिया को धीमा करता है।
यह देखा गया कि सी. एलेगेन्स को लीथियम क्लोराइड का उपचार देने पर भी उसकी जीवन अवधि बढ़ती है।
सी. एलेगेन्स के अध्ययन का एक विषय टीलोमेयर पर केंद्रित रहा है। टीलोमेयर (telomere) सूणसूत्रों के सिरों पर डीएनए की दोहराई जानी वाली शृंखला होती है। यह गुणसूत्र को क्षति से बचाती है और हर कोशिका विभाजन के बाद छोटी होती जाती है। इसकी लंबाई एक हद से कम हो जाने के बाद वह कोशिका आगे विभाजन नहीं कर पाती और झड़ जाती है।
लेकिन सी. एलेगेन्स के अध्ययन में एक विचित्र बात पता चली। ड्रॉसोफिला मेलानोगैस्टर जैसे कई जंतुओं में टीलोमेयर की लंबाई को बनाए रखने की विधि में रिट्रोट्रांसपोज़ॉन्स की भूमिका देखी गई है। रिट्रोट्रांसपोज़ॉन्स डीएनए के ऐसे खंड होते हैं जो एक जगह से दूसरी जगह फुदकते रहते हैं। लेकिन सी. एलेगेन्स में टीलोमेयर की सुरक्षा के लिए सामान्य तरीके के अलावा एक अलग तरीके का उपयोग देखा गया है, जिसे वैकल्पिक टीलोमेयर लेंदेनिंग (ALT) कहते हैं। सी. एलेगेन्स वह पहला यूकेरियोट जीव था जिसने सामान्य टीलोमेयर प्रक्रिया को ठप किए जाने के बाद ALT हासिल कर ली। इसी तरह ALT कई कैंसर में देखी गई है जो कई परिस्थितियों में अपना टीलोमेयर लंबा करती रहती हैं। ऐसे कैंसर ज़्यादा घातक (aggressive cancer) साबित होते हैं। लिहाज़ा सी. एलेगेन्स ALT अध्ययन के लिए एक अहम मॉडल है। (स्रोत फीचर्स)
नोट: स्रोत में छपे लेखों के विचार लेखकों के हैं। एकलव्य का इनसे सहमत होना आवश्यक नहीं है।
Photo Credit : https://upload.wikimedia.org/wikipedia/commons/c/cc/Adult_Caenorhabditis_elegans.jpg